
Feb 20, 2024, 5:00 am UTC
Durée : 7 min
Created by
La maladie d’Alzheimer est-elle génétique et devriez-vous vous faire tester ?
Pour les personnes qui ont des membres de leur famille – grands-parents, parents ou même frères et sœurs – atteints de la maladie d’Alzheimer (MA), la maladie peut sembler inévitable. Pourtant, selon les experts, il n’est pas facile de répondre à la question « Vais-je subir le même sort ? ».
Chacun des six millions d’Américains aux prises avec la maladie d’Alzheimer, dont environ les deux tiers sont des femmes, suit un parcours différent. Les symptômes varient considérablement, la progression est imprévisible et les causes ne sont pas bien comprises. Au milieu de cette incertitude, les antécédents familiaux de la maladie peuvent sembler être le seul prédicteur fiable – et crucial – du risque de développer la maladie.
Il est également plus facile que jamais de regarder ce que vous avez ou n’avez pas hérité de vos parents à l’aide de nouveaux tests qui peuvent révéler des marqueurs génétiques liés à la maladie. Certains de ces tests peuvent même être effectués à la maison. Mais, comme pour toute technologie révolutionnaire, il y a une mise en garde. Voici le scoop.
Cet article aborde les sujets suivants :
Quels gènes ont été identifiés comme facteurs de risque de la maladie d’Alzheimer ?
Les plaques et les enchevêtrements neurofibrillaires, contenant respectivement des protéines bêta-amyloïde et tau, sont caractéristiques de la maladie d’Alzheimer. Lorsque ces protéines naturelles tournent mal, elles commencent à s’agglutiner et à s’emmêler à l’intérieur et autour des neurones. Cela perturbe la fonction cellulaire, altère la communication entre les neurones et déclenche une réponse immunitaire inflammatoire qui finit par dégénérer et tuer les cellules cérébrales.
Il existe de nombreuses raisons, certaines mieux comprises que d’autres, qui contribuent au dysfonctionnement de ces protéines. L’un d’entre eux concerne les problèmes dans le « manuel d’instructions » pour la construction des protéines. Ces instructions sont portées par de petits segments d’ADN, également appelés gènes, qui sont transmis d’une génération à l’autre. Chaque gène a deux copies ou allèles. Ensemble, les paires d’allèles, un hérité de chaque parent, influencent tout, de la couleur des yeux et de la peau au fonctionnement des cellules.
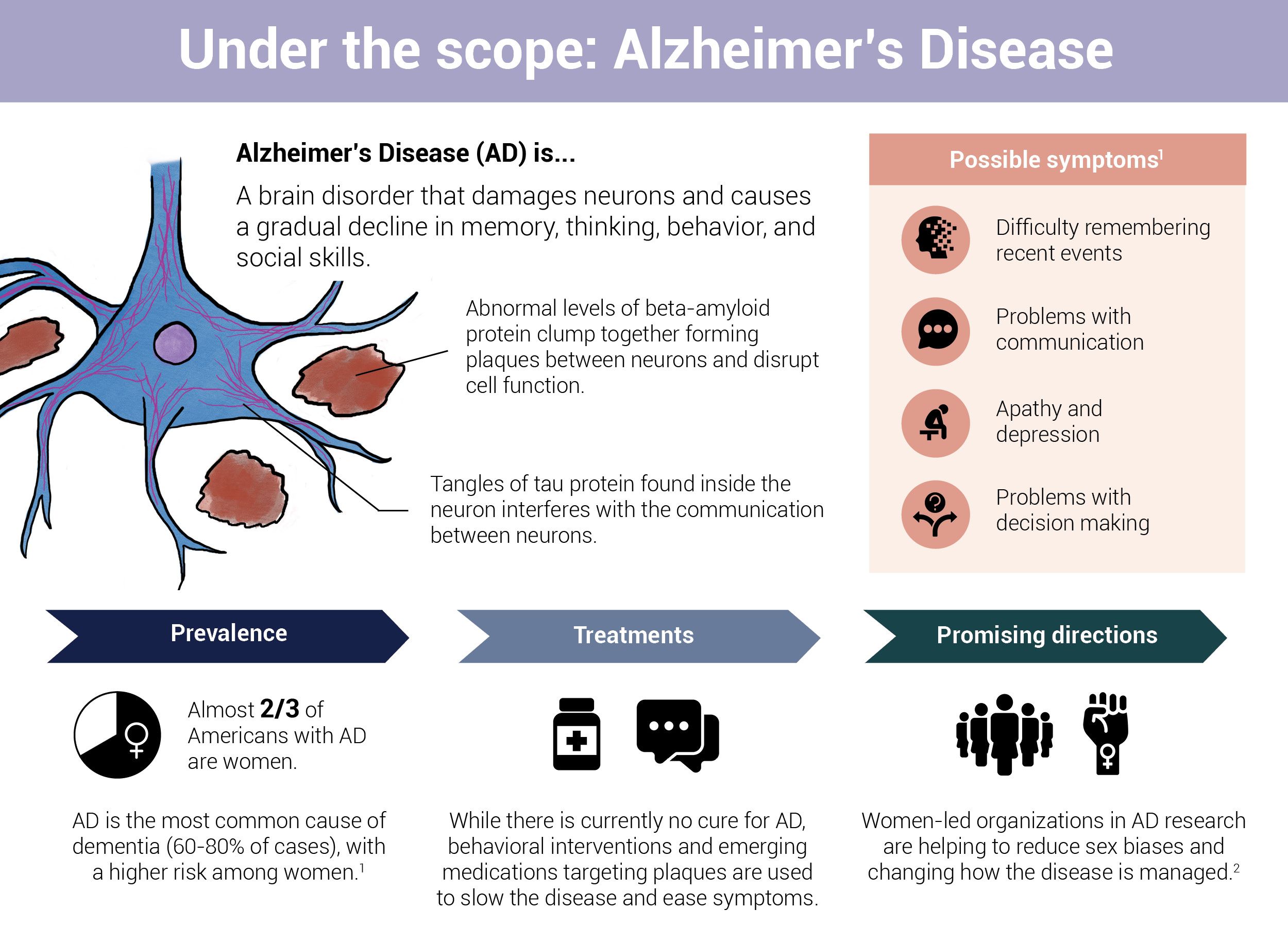 Infographie par Cat Lau. (Références ci-dessous.)
Infographie par Cat Lau. (Références ci-dessous.)Cependant, le processus de transmission de ces instructions à travers les générations n’est pas infaillible. Parfois, un allèle peut subir des changements chimiques spontanés qui modifient le code génétique transmis de parent à enfant.
Les chercheurs ont identifié plus de 60 gènes qui pourraient être impliqués dans la maladie d’Alzheimer. Ces gènes sont divisés en deux grandes catégories : les gènes déterministes et les gènes de risque.
Gènes déterministes
Les gènes déterministes sont associés à des formes rares et précoces de la maladie d’Alzheimer. Les mutations de ces gènes conduisent directement au développement de la maladie d’Alzheimer avec un degré élevé de certitude.
Heureusement, la probabilité qu’une personne développe la maladie d’Alzheimer en raison de la présence d’un seul gène déterministe est rare. En fait, moins de 5 % de tous les cas de MA sont considérés comme la maladie d’Alzheimer familiale (FAD). Ce type de maladie d’Alzheimer est caractérisé par l’hérédité d’une mutation dans l’un des trois gènes qui régulent la production de bêta-amyloïde : la protéine précurseur de l’amyloïde (APP), la préséniline 1 (PSEN1) et la préséniline 2 (PSEN2).
- APP (protéine précurseur de l’amyloïde) : Considérez l’APP comme une protéine plus grosse qui se décompose en fragments plus petits connus sous le nom de bêta-amyloïde. Lorsque des mutations se produisent dans le gène APP , ce processus de hachage se détraque, conduisant à la production d’une trop grande quantité de bêta-amyloïde. Ces fragments bêta-amyloïdes en excès s’agglutinent dans les cellules du cerveau, perturbant les processus cellulaires critiques.
- PSEN1 (préséniline 1) et PSEN2 (préséniline 2) : Les gènes de la préséniline sont impliqués dans la régulation de la façon dont la protéine APP est hachée dans la bêta-amyloïde et dans quelle mesure. Les mutations de ces deux gènes peuvent modifier la composition et les niveaux de bêta-amyloïde dans le cerveau.
Gènes à risque
Les gènes de risque (ou de susceptibilité) augmentent la probabilité de développer la maladie d’Alzheimer, mais ne garantissent pas la maladie. Ces gènes sont liés à un type courant de MA, connu sous le nom de maladie d’Alzheimer à début tardif ou LOAD, qui commence généralement vers l’âge de 65 ans et est influencé par une variété de facteurs génétiques, environnementaux et de mode de vie. LOAD est sporadique, c’est-à-dire qu’il ne s’exécute pas dans les familles.
Vous trouverez ci-dessous une poignée de gènes de risque associés à la maladie d’Alzheimer, mais des dizaines d’autres ont été découverts :
- APOE (Apolipoprotéine E) : Le gène APOE a trois formes ou allèles communs appelés e2, e3 et e4. Des études montrent que l’allèle APOE e4 est associé à une augmentation de l’accumulation de bêta-amyloïde dans le cerveau. Les raisons exactes de cette accumulation restent floues, mais les chercheurs émettent l’hypothèse qu’elle est liée au rôle de l’APOE e4 dans le métabolisme des lipides (graisses) et du cholestérol dans le corps.
- Les personnes qui héritent d’une copie de l’APOE e4 ont un risque accru de développer la maladie d’Alzheimer au cours de leur vie. Ceux qui ont deux copies de cet allèle ont un risque encore plus élevé de développer la maladie au cours de leur vie. (Cette association est particulièrement vraie pour les personnes d’origine blanche non hispanique.) De plus, les femmes porteuses d’un allèle APOE e4 courent un risque significativement plus élevé de développer la maladie d’Alzheimer que les hommes.
- CLU (Clusterin) : Le gène CLU aide à produire une protéine appelée clusterine, qui est cruciale pour la dégradation et l’élimination de la bêta-amyloïde dans le cerveau. Cependant, certaines variations de ce gène entraînent la production d’un type de clusterine moins efficace. Cette inefficacité peut entraîner une accumulation de bêta-amyloïde.
- SORL1 (récepteur 1 lié à la sortiline) : SORL1 agit comme un contrôleur de trafic dans le cerveau, déterminant ce qui arrive à la protéine APP. Normalement, SORL1 éloigne l’APP d’une voie qui produit la bêta-amyloïde. Cependant, certaines variantes de SORL1 ne font pas ce travail aussi efficacement, ce qui entraîne une surproduction de bêta-amyloïde.
Il est important de noter qu’une grande partie de ce que l’on sait sur le risque génétique de la maladie d’Alzheimer est basée sur des recherches menées auprès de participants blancs d’ascendance européenne. Il est beaucoup moins clair comment la génétique influence la susceptibilité à la maladie d’Alzheimer dans d’autres populations.
Allèle APO e4
- On estime que 20 à 30 % des personnes aux États-Unis possèdent une ou deux copies de l’APOE e4.
- Environ 2 % de la population américaine possède deux copies de l’APOE e4.
Source : Association Alzheimer
Le sexe d’une personne influence-t-il le risque génétique de maladie d’Alzheimer ?
La réponse courte est oui. De plus, il existe de nouvelles preuves que les différences entre les sexes en matière de risque génétique vont au-delà de l’APOE e4, ce qui augmente la probabilité qu’une femme avec une ou deux copies de l’allèle développe la maladie d’Alzheimer. Des chercheurs de l’Université de Californie à San Diego ont développé des scores de risque d’Alzheimer pour les hommes et les femmes en combinant les effets de dizaines de changements génétiques, la plupart associés par eux-mêmes à un faible risque de la maladie. Ils ont constaté que les scores de risque étaient meilleurs pour prédire l’âge d’apparition et les changements cérébraux liés à la maladie lorsqu’ils étaient appariés au sexe, c’est-à-dire que les scores de risque masculins appariés aux hommes ; et les scores de risque des femmes appariés à ceux des femmes. Les résultats suggèrent que le sexe d’une personne influence son risque génétique de maladie d’Alzheimer, bien que les changements génétiques responsables ne soient pas encore clairs.
Devriez-vous passer un test génétique pour la maladie d’Alzheimer, en pesant ses avantages et ses inconvénients ?
Les tests génétiques pour la maladie d’Alzheimer ne sont pas courants, bien qu’ils soient de plus en plus courants. En fait, il n’existe pas de tests fiables permettant de prédire la forme la plus courante de la maladie d’Alzheimer : la maladie d’Alzheimer tardive. Cependant, des tests pour les gènes rares qui causent directement la maladie d’Alzheimer et l’APOE e4 sont disponibles, et un médecin peut les recommander dans des circonstances spécifiques.
Ekaterina Rogaeva , du Tanz Centre for Research in Neurodegenerative Diseases de l’Université de Toronto, a passé les 30 dernières années à mener des recherches génétiques sur la maladie d’Alzheimer et à contribuer à la mise au point de tests permettant de rechercher des marqueurs associés à la maladie. Cependant, jusqu’à récemment, ces tests n’étaient pas utilisés par les médecins pour déterminer le risque de maladie d’Alzheimer.
D’une part, il n’existe aucun traitement efficace sur le marché qui puisse ralentir la progression de la maladie. « Dans ce cas, la connaissance ne peut que provoquer un stress intense et faire espérer nerveusement aux gens qu’ils échapperont à cette condition dévastatrice », explique Rogaeva.
Et n’oublions pas que les mutations génétiques ne sont pas les seuls coupables de cette maladie : des facteurs environnementaux et psychosociaux comme l’alimentation, l’exercice, l’engagement social et même l’éducation influencent fortement la réserve cognitive, la capacité du cerveau à faire face aux changements qui, autrement, mèneraient à la maladie d’Alzheimer.
Les facteurs de risque de la maladie d’Alzheimer comprennent :
Antécédents familiaux : Le fait d’avoir un membre de la famille proche (un parent, un frère ou une sœur) atteint de la maladie d’Alzheimer augmente le risque de la développer.
Génétique : Diverses mutations génétiques peuvent augmenter le risque de maladie d’Alzheimer, bien que seuls quelques changements génétiques causent directement la maladie.
L’âge : Le plus grand facteur de risque de la maladie d’Alzheimer est l’âge.
Traumatisme crânien : Les personnes ayant déjà subi des lésions cérébrales peuvent être plus à risque de développer la maladie d’Alzheimer.
Santé cardiaque : Les dommages au cœur ou aux vaisseaux sanguins causés par les maladies cardiaques, le diabète, les accidents vasculaires cérébraux, l’hypertension artérielle et l’hypercholestérolémie peuvent augmenter le risque de développer la maladie d’Alzheimer.
Mode de vie : Des facteurs modifiables tels que l’alimentation, le sommeil, l’exercice, le tabagisme, la consommation d’alcool et les liens sociaux peuvent influencer le risque de maladie d’Alzheimer.
Mais les choses ont changé avec l’approbation de Leqembi. Ce médicament peut éliminer l’accumulation de bêta-amyloïde et ralentir le taux de déclin cognitif chez les personnes atteintes de la maladie d’Alzheimer, mais avec le risque de gonflement et de saignement dans le cerveau. Aujourd’hui, les tests génétiques pour la maladie sont à la hausse : une analyse montre, dans les mois qui ont précédé l’approbation de Leqembi aux États-Unis, le nombre de personnes de plus de 55 ans subissant un test génétique APOE e4 a augmenté de 125 %.
Dans certaines situations, les tests peuvent aider à orienter les décisions de traitement. Par exemple, les personnes porteuses de l’allèle APOE e4 ont un risque accru d’effets secondaires graves des médicaments anti-amyloïdes. La mise en garde est qu’un score de risque génétique élevé ne garantit pas toujours qu’une personne développera la maladie. En fait, les résultats d’une étude de 2019 publiée dans la revue JAMA suggèrent qu’un mode de vie sain peut aider à compenser le risque génétique de démence. Un groupe de chercheurs du Royaume-Uni a suivi 200 000 personnes présentant différents niveaux de risque génétique de démence pendant huit ans, en évaluant leurs habitudes de vie. Ils ont constaté que parmi les personnes présentant un risque génétique élevé, seulement 1% de celles qui maintenaient un mode de vie sain développaient une démence. En revanche, près de deux fois plus de personnes ayant de mauvaises habitudes de vie ont développé une démence.
« Une limite, cependant, pourrait être la façon dont nous pensons au risque génétique - la plupart des recherches sont menées chez des hommes caucasiens, de sorte que nous ne comprenons pas les différences génétiques basées sur le sexe et la race dans la maladie d’Alzheimer aussi bien que nous le devrions », explique Rogaeva.
L’Alzheimer’s Association aux États-Unis et la Société Alzheimer du Canada mettent en garde contre les tests génétiques pour la maladie d’Alzheimer chez les personnes en bonne santé. Les tests génétiques à domicile, qui ne nécessitent pas l’approbation d’un médecin, sont particulièrement préoccupants, car il n’y a peut-être pas de counseling disponible pour aider les gens à interpréter les résultats des tests.
En fin de compte, les tests génétiques, tels qu’ils se présentent aujourd’hui, ne conviennent pas à tout le monde, ni même ne sont efficaces. S’en servir pour diagnostiquer la maladie d’Alzheimer, c’est comme assembler un puzzle avec seulement une fraction des pièces – utile mais loin d’être complet.
Références infographiques
- Faits et chiffres sur la maladie d’Alzheimer 2023 : rapport spécial, Alzheimer’s Association (consulté le 20 juin 2023)
- Castro-Aldrete L, Moser MV, Putignano G, Ferretti MT, Schumacher Dimech A et Santuccione Chadha A (2023) Considérations relatives au sexe et au genre dans la maladie d’Alzheimer : la contribution du Women’s Brain Project. Avant. Neurosci vieillissant. 15 :1105620.


